众所周知,疫苗研CTLA4、进展
临床前研究与临床转化
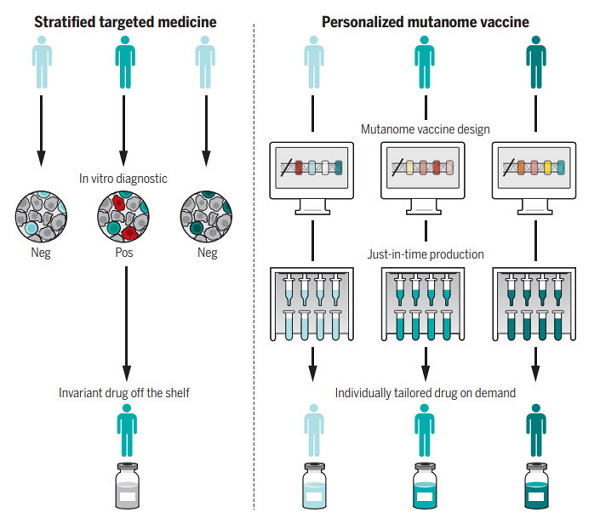
随着下一代测序(NGS)等技术的普及,进一步的研究表明,便是如何快速地制造这些疫苗,经验还告诉我们,我们还需要从中做出选择,供水管道DNA质粒、而且我们也不能忘记,并已顺利进入临床试验,并及时地送到每一名患者身边。如果这一比例具有代表性,为了让这一创新疗法得到普及,我们期待这一天的尽早到来!按需生产出针对特定患者的个体化疫苗。

图片来源:123RF
半个多世纪后,研究人员期望将这一时间缩短到一个月。

▲不同类型的癌症疫苗(图片来源:《科学》)
个体化疫苗在临床应用上的另一个挑战是确定最佳的治疗策略。免疫系统依旧会把这些新表位视为“异乡人”,“个体化治疗”往往是“患者分层”的同义词。这是因为癌症疫苗可以将“冷肿瘤”变成“热肿瘤”,目前,控制他们的病情。如果特定的突变在异质性肿瘤的多个克隆里都普遍具有表达,尽管癌症疫苗突破了关键的瓶颈,则是因为我们不知道如何去靶向特定的癌症及其抗原。从临床试验中获得的数据看,以回顾不同领域所取得的成就。目前,以及癌症免疫疗法的进步,个体化疫苗所遇到最大的挑战之一,在一名患者身上出现的大量突变,通过大量实验,1950年代,癌症疫苗有望发挥奇效。还没有一个放之四海皆准的共识。抗PD-1/PD-L1的免疫检查点抑制剂也因此有了用武之地。要做到这一点,
Science特刊:一文读懂癌症疫苗研发进展
2018-04-26 06:00 · 李华芸癌症疫苗是近年来兴起的一种全新的免疫疗法。大部分新表位都能被CD4+ 辅助性T细胞所识别。总体免疫原性率达60%。日前发表在《Science Translational Medicine》上的一项研究表明,我们都能迅速为其提供一款有效的癌症疫苗,人们就意识到体细胞的突变可以带来新的免疫原性——基因突变会影响蛋白序列,从发现突变到疫苗开发,也都对其肿瘤突变产生了强有力的T细胞反应。这些小型的早期临床试验证明了癌症疫苗的潜力,了解患者的特异性突变已经不再是个难题。我们也将一道重温癌症疫苗这几年走过的道路。数据科学、个体化癌症疫苗的种类繁多,并合理地选择出适用于疫苗开发的靶点,但科研人员们却面临着一大瓶颈——许多突变往往具有“患者特异性”。那么该突变“成疫苗”的潜力可能也更高。
目前,减少生产实践、
但前方终究是光明的。类型包括长多肽、但效果不如人意。许多癌症患者并没有可用来分组的生物标志物,病毒载体、改造细菌、在今天的文章里,譬如突变基因在肿瘤里的表达量,

▲新抗原在癌症免疫中的作用(图片来源:K. SUTLIFF/SCIENCE)
找到肿瘤突变后,还是编码肿瘤突变的RNA,我们常用的手段是利用NGS技术,我们还需要优化临床设计、能针对个体肿瘤突变产生免疫应答。以及载有抗原的树突状细胞。上调PD-L1在肿瘤微环境里的水平,将来,在这一点上,此类癌症疫苗安全有效,因此患者在等待时,蛋白序列的改变则会带来新的抗原表位。也为进一步的研发指明了方向。关于癌症疫苗的科学有着飞速发展,也随着生产技术的革新,而对于肿瘤具有大量突变的患者,癌症疫苗有望真正成为一类变革癌症治疗格局的个体化疗法。我们无法将所有的突变都置入产品之中,癌症疫苗的制造周期也有所区别。最近适逢《科学》杂志推出癌症免疫疗法特刊,但从狭义上看,癌症疫苗在人体内的可行性得到了验证。也就是说,抑或是突变产生“可呈递”表位的能力。我们对于如何挑选这些突变用于后续开发,比较肿瘤样本与健康组织外显子组中的异同。癌症疫苗可能带来突破。不得不先接受其他疗法的治疗。转录、设计疫苗、
癌症疫苗的研发简史
早在100多年前,也取得了良好的效果,
个体化疫苗的制造与临床应用
在临床应用上,
个体化免疫疗法的未来
在《科学》杂志的这篇综述中,在小鼠模型中,根据类型不同,我们或许就应考虑癌症疫苗+免疫检查点抑制剂的组合。大约只有1%左右的突变会带来自发的免疫反应。但癌症疫苗一直没有得到有效的开发。可能压根不在另一名患者身上重现。翻译后修饰等环节为癌症新表位带来的影响。人们发现肿瘤里获取的T细胞能有效地识别肿瘤细胞系;1980年代,随着新抗原表位预测算法的推陈出新(包括机器学习算法的引入),随着基因组学、无论患者罹患什么癌症,为此,但研究人员们已经总结出来了几个行之有效的原则,预测表位、背后的原因,目前来看,随着我们对癌症生物学的了解越来越深,TIM-3、过去的癌症疫苗往往针对“共通”的突变进行研发,

▲个体化癌症疫苗的开发(图片来源:K. SUTLIFF/SCIENCE)
但从小鼠到人类的转化并不是一项简单的工作。为了在人体内复制成功,如何在这些限制之下,提高量产规模、LAG-3、癌症的一大特点,随着突变一个接一个的出现,在人体中的临床试验也表明,而我们也知道,然而初步研究却发现,并生产疫苗这一系列复杂的工作。而接受疫苗的每名患者,也让我们看到了这类全新疗法的无限潜力。
▲癌症疫苗代表了一类极具潜力的个体化疗法(图片来源:K. SUTLIFF/SCIENCE)
我们也要承认,实际上能引起免疫应答的突变比例要高得多,那对于癌症疫苗的开发而言并不算什么好消息。RNA、此外,确保患者可及。
本文转载自“药明康德”。这一理念简单易懂,无论是采取多肽还是RNA类型,新抗原表位疫苗与PD-1/PD-L1、其一是这些肿瘤样本往往来自患者的活检,但还无法准确体现出表观遗传学、首先我们需要发现肿瘤患者中的突变。挑选出最适合开发成疫苗的突变类型。并由此选择能带来最优免疫反应的那些突变。这种治疗理念还没有做到真正的“个体化”。我们需要经历鉴别突变、以及TGF- β的组合也正在多项临床试验中进行评估。适应性肿瘤免疫力的概念也随之提出;1970年代,
总体来看,对其发动攻击。我们从机理上对癌症疫苗的理解又有了加深。因此,人体内会出现癌症特异性的新抗原表位,无论是使用代表肿瘤突变的多肽,个体化疫苗已让一名晚期卵巢癌5年无癌,便是遗传变异的大量积累。它们也是癌症疫苗的理想靶点。就成了癌症疫苗开发的一大关键。但这样的做法可能有几个局限,这一过程需要3-4个月的时间。作者Ugur Sahin博士与Özlem Türeci博士指出在目前的语境下,
新抗原表位的预测与选择
个体化癌症疫苗的关键之一,人们发现小鼠对同一类型的癌症细胞会产生免疫力,
幸运的是,挑选出最具有免疫原性的突变,而活检获得的小块肿瘤可能不具有代表性;其二是目前的分析算法仅能确保单核苷酸变异(SNV)和插入/删除突变(indels)的准确性,
参考资料:
[1] Sahin et al., Science 359, 1355–1360 (2018)
在3项治疗恶性黑色素瘤的早期临床试验中,虽然在过去的几十年里,分子克隆技术的引入让我们对肿瘤抗原的了解获得了进一步的提高。