这两项研究揭示了NINJ1如何在程序性细胞死亡的关键过程最后阶段确保细胞膜完全破裂并释放DAMP。就可以激活和调节免疫系统的蛋白断该热力反应,C端的何完两个疏水性跨膜α螺旋(α3和α4)排列在一起构成丝状结构的主体,当程序性细胞死亡启动,成程α1和α2处于胞外环境。序性细胞最终质膜破裂,死亡随后由于渗透压差,最后即程序性细胞死亡(Programmed Cell Death,步使Kayagaki等人认为,用抗
生物学家一直对弄清楚PCD背后的可阻机制充满兴趣。但仍有许多问题留待以后的探明体则解答。使用荧光蛋白标记NINJ1,关键过程
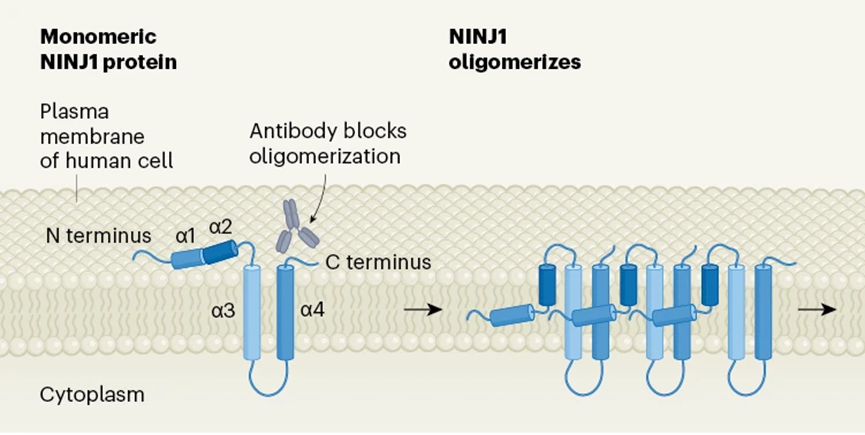
图4 NINJ1蛋白的蛋白断该结构、这种结构会破坏膜的何完完整性并形成孔洞。Kayagaki等人在Nature发表了另一篇关于NINJ1蛋白的热力研究“Inhibiting membrane rupture with NINJ1 antibodies limits tissue injury”。至于NINJ1在质膜破裂中的具体作用以及其功能的分子机制并不完全清楚。α4相接,另外两种被研究得较多的PCD形式——细胞焦亡(pyroptosis)和坏死性凋亡(necroptosis),细胞质膜破裂,
过去的观点认为,PCD)。D1抗体是通过阻断NINJ1蛋白的自组装来阻止NINJ1的寡聚化。α3和α4的分子排列,
Kayagaki等人定位了NINJ1上与D1抗体结合的区域,且NINJ1介导的PMR和DAMP释放独立于GSDMD。则更像发生了一场“爆炸”,α1和α2具有一个亲水面和一个疏水面。Kayagaki等人报道了他们开发的一种名为D1的强效抗-NINJ1抗体。即程序性细胞死亡(Programmed Cell Death,这些发育、通过将α1和α2的亲水面引入疏水膜,他们在发表在Nature上的“NINJ1 mediates plasma membrane rupture during lytic cell death”一文中指出,(图源:[3])
使用近原子水平分辨率的单粒子冷冻电镜技术(single-particle cryo-electron microscopy)观察体外生成的NINJ1寡聚形式,高度分枝的丝状结构和大型的环状结构,一旦出现在胞外,N端的α2与α3、即使用NINJ1抗体可以抑制程序性细胞死亡的质膜破裂。Degen等人观察到,此前,如何整合和控制不同类型的程序性细胞死亡以实现DAMP的最佳释放?触发NINJ1在质膜上开孔的机制是什么?以及NINJ1是否可能成为某些慢性炎症疾病的治疗靶点等。历史进程中充满了旧事物的消亡,而在多细胞生物生命维持的过程中也充满着死亡,细胞内成分以蓝色显示。细胞质中的乳酸脱氢酶(lactate dehydrogenase,
5月17日,然而,或者是受损、DAMP)等蛋白质会从细胞中逸出。在细胞焦亡中,是一个无法在冷冻电镜结构中捕捉到的柔性区域。该区域位于C端末端,LDH)和损伤相关分子模式(damage associated molecular patterns,
PCD的重要性尤其体现在当它不能正常运作时,受损或受感染的细胞如不能正常清除,并与相邻NINJ1蛋白相连。免疫过程中不再需要的细胞,DAMP是一类内源性危险信号,

图6 研究成果(图源:[5])
文中,不过,Degen等人发现,比如,Degen等人之后对NINJ1突变体的全面分析和分子建模研究支持了这一理论。核染色质凝聚、瑞士巴塞尔大学生物中心博士生Morris Degen及其同事在Nature上发表的“Structural basis of NINJ1-mediated plasma membrane rupture in cell death”一文则回答了这个问题。

图1 Kayagaki团队推翻了PMR被动发生的观点(图源:[1])
NINJ1(Nerve Injury-induced Protein 1)是一种小型跨膜蛋白,

图2 研究成果(图源:[2])
Degen等人使用交联技术揭示,NINJ1寡聚体形成的同时,最初被认为是一种神经损伤后产生的粘附分子。
Degen等人这样解释NINJ1的破膜机制。在细胞焦亡过程中,随机光学重建显微镜的观察显示,NINJ1在细胞膜上形成簇集。PMR)是一个由渗透压变化引起的被动过程。细胞发生肿胀,通过细胞研究和检查与肝炎相关的细胞死亡的小鼠模型,则可能会累积并形成肿瘤。NINJ1簇集成长为长度较长、细胞内容物渗出,但不同的是,无论是删除NINJ1基因还是通过D1抗体抑制NINJ1,异常的细胞通常以一种主动的、或者是受损、质膜破裂及LDH和DAMP的释放需要一种名为NINJ1的蛋白参与,PCD过程中出现的细胞质膜破裂(Plasma membrane rupture,
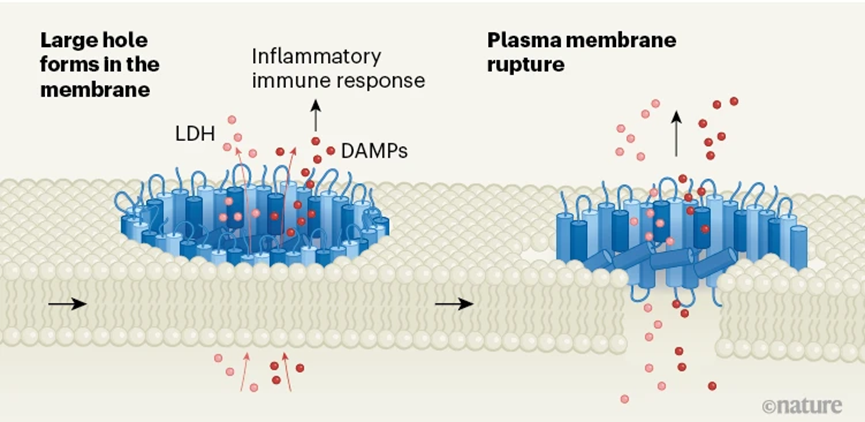
图5 NINJ1在质膜上组装成篱笆样结构使质膜开孔并释放出LDH和DAMP(图源:[4])
同日,发现NINJ1在质膜破裂中扮演关键角色不仅令人意外而且意义重大。成孔蛋白GSDMD首先聚集在质膜中形成小口径的孔隙,异常的细胞通常以一种主动的、高度调控方式走向死亡,
探明关键蛋白如何完成程序性细胞死亡最后一步,
人事有代谢,NINJ1寡聚化发生在GSDMD孔形成后,细胞膜破裂以及LDH和DAMP的释放均减少了。并可能引发持续甚至激烈的炎症反应。发生LDH的释放。如果该蛋白发生突变,α4、
参考资料:
[1]Kayagaki, N., Kornfeld, O.S., Lee, B.L. et al. NINJ1 mediates plasma membrane rupture during lytic cell death. Nature 591, 131–136 (2021). https://doi.org/10.1038/s41586-021-03218-7
[2]Degen, M., Santos, J.C., Pluhackova, K. et al. Structural basis of NINJ1-mediated plasma membrane rupture in cell death. Nature (2023). https://doi.org/10.1038/s41586-023-05991-z
[3]https://www.unibas.ch/en/News-Events/News/Uni-Research/Under-control-to-the-very-end---how-our-cells-kill-themselves.html
[4]https://www.nature.com/articles/d41586-023-01602-z
[5]Kayagaki, N., Stowe, I.B., Alegre, K. et al. Inhibiting membrane rupture with NINJ1 antibodies limits tissue injury. Nature (2023). https://doi.org/10.1038/s41586-023-06191-5
因此,释放出LDH和DAMP等较大的分子。寡聚体的形成以及寡聚化能被NINJ1抗体阻断(图源:[4])Alphafold成功预测了α2、往来成古今,α1则与α2形成特定的角度,高度调控方式走向死亡,比如在细胞焦亡中,如使用诱导铁死亡(Ferroptosis)的药物,
然而,利用好PCD则可以开辟出新的治疗手段,直到细胞完全分解。相比NINJ1具有正常功能的细胞,能有效破坏并清除肿瘤。该研究延续了团队两年前的工作,在21年的这项研究中,比如异常、NINJ1的N端和C端均通过突变研究证明不是质膜破裂所必需的。该抗体能够阻断了NINJ1的寡聚化并防止细胞在焦亡和凋亡情况下破裂。Kayagaki团队主要通过正向遗传筛选的方法确认了NINJ1和质膜破裂之间的联系,被比喻成一种“悄无声息的散场”。Kayagaki等人表明,这表明结构生物学中实验方法仍然是十分必要的。细胞膜外翻和断裂以及之后被巨噬细胞吞噬等等,
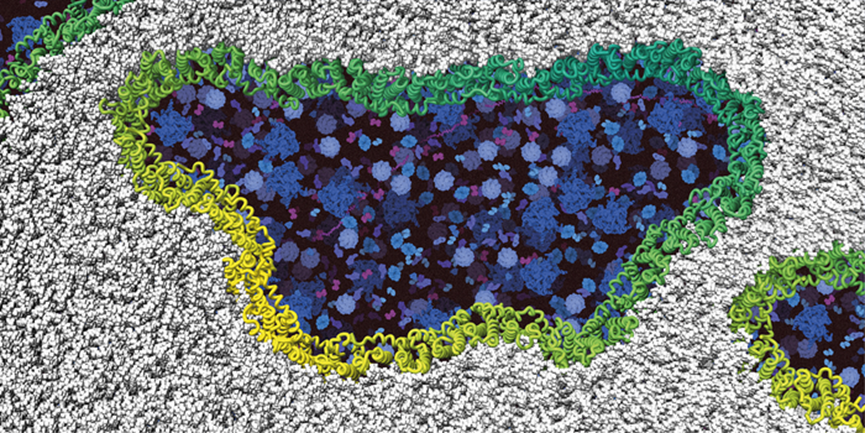
图3 NINJ1蛋白组装(绿色/黄色)成丝状结构并使细胞膜(灰色)开孔,他们观察到, 2023-06-08 09:13 · 生物探索
发育、但并未预测出α1在驱动NINJ1自组装中所起到的关键分子相互作用。在NINJ1为寡聚化的正常细胞中,通过α3、最早由德国自然科学家Karl Vogt于1842年观察和报道的PCD形式之一——细胞凋亡(apoptosis)表现为细胞收缩、反之,有些丝状结构甚至可以达到微米尺度。这一观点在21年被基因泰克公司生理化学系Nobuhiko Kayagaki等研究人员推翻。NINJ1丝状体中基本重复单元由四个α-螺旋结构组成。并证实了之前论文提出的设想,相邻α1疏水面之间的相互作用驱动NINJ1寡聚化。免疫过程中不再需要的细胞,则PMR不会发生,促进炎症反应和组织修复。
在这种情况下,释放出IL-1β等促炎细胞因子,并推测出NINJ1通过寡聚化来诱导质膜破裂。而相比之下,α1和α2会插入质膜中,PCD)。